
Contents
Khái niệm về Bảng tuần hoàn hoá học lớp 7
Bảng tuần hoàn hoá học có tên đầy đủ là Bảng tuần hoàn các nguyên tố hoá học. Hay còn được viết với cái tên Bảng tuần hoàn Mendeleev. Đây là một phương pháp liệt kê các nguyên tố hoá học thành dạng bảng, dựa theo số hiệu nguyên tử (số proton trong hạt nhân), cấu hình electron và các tính chất hóa học tuần hoàn của các nguyên tố này. Các nguyên tố sẽ được biểu diễn theo trật tự số hiệu nguyên tử tăng dần và thường liệt kê cùng với ký hiệu hoá học trong mỗi ô. Dạng tiêu chuẩn của bảng tuần hoàn hóa học bao gồm các nguyên tố được sắp xếp thành 18 cột và 7 dòng, với hai dòng kép nằm riêng bên dưới cùng.

Bảng tuần hoàn các nguyên tố hóa học
Nguồn gốc của bảng tuần hoàn hoá học
– Năm 1789, nhà khoa học người Pháp Antoine Lavoisier đã công bố ra bản danh sách gồm 33 nguyên tố hoá học. Trong đó phân chúng thành các nhóm khí, kim loại, phi kim và cả “đất”. Đây cũng chính là nỗ lực đầu tiên được ghi lại.
Đến năm 1864, Julius Lothar Meyer- người đưa ra bảng các nguyên tố gồm 44 nguyên tố được xếp theo hoá trị. Còn ông William Odling cũng đưa ra 57 nguyên tố. Trong những năm tiếp theo, nhiều nhà khoa học khác cũng đã công bố các công trình nghiên cứu về quy luật của các nguyên tố hoá học. Họ dựa theo nhiều tiêu chí, tuy nhiên đều không được ghi nhận bởi giới chuyên môn.
Bên cạnh đó, tại Anh, nhà nghiên cứu John Newlands đã sắp xếp các nguyên tố dựa trên khối lượng nguyên tử của chúng. Và ghi nhận tính tuần hoàn theo vòng lặp của 8 nguyên tố. Vòng lặp này còn được gọi là “quãng tám” giống như các quãng trong âm nhạc.
Tại Hoa Kỳ, nhà khoa học Gustavus Hinrichs đã công bố ra bảng tuần hoàn hoá học dựa trên phổ, khối lượng nguyên tử và các tính chất hoá học của các nguyên tố. Tuy vậy, cả hai công bố trên đều đã bị phản đối trong giới học thuật.
Đến năm 1869, nhà hoá học người Nga Dmitri Mendeleev được công bố. Sau đó chính thức được công nhận, Bảng tuần hoàn hoá học của ông cũng đã được sắp xếp dựa trên khối lượng nguyên tử và sự lặp lại của các thuộc tính của nguyên tố. Chính từ đó, phiên bản này trở thành phiên bản phổ biến nhất. Đồng thời sử dụng chính thức trong các chương trình nghiên cứu, tài liệu và trong sách giáo khoa trong trường học.
Nguyên tắc sắp xếp nguyên tố trong bảng tuần hoàn hóa học lớp 7
– Năm 1869, nhà bác học người Nga- ông D. I. Mendeleev đã xây dựng bảng tuần hoàn theo chiều tăng dần khối lượng của nguyên tử.
– Các nhà khoa học ngày nay chứng minh điện tích hạt nhân nguyên tử mới là cơ sở để xây dựng bảng tuần hoàn.
– Tính đến nay, bảng tuần hoàn các nguyên tố hoá học gồm tổng có 118 nguyên tố được xây dựng theo nguyên tắc sau:
+ Các nguyên tố hóa học sắp xếp theo chiều tăng dần của số điện tích hạt nhân.
+ Các nguyên tố hóa học trong cùng một hàng sẽ có cùng số lớp electron trong nguyên tử.
+ Các nguyên tố hóa học trong cùng một cột sẽ có tính chất hóa học gần giống nhau.
Tham khảo: Cách viết đơn xin ly hôn
Cấu tạo của bảng tuần hoàn hóa học
- Ô nguyên tố
– Mỗi nguyên tố hoá học sẽ được sắp xếp vào một ô của bảng tuần hoàn. Đây còn được gọi là ô nguyên tố.
Ví dụ 1: Ô nguyên tố cacbon sẽ cung cấp các thông tin về nguyên tử carbon.

Ô nguyên tố cacbon
– Ô nguyên tố sẽ cho biết:
Số hiệu nguyên tử (Z).
Kí hiệu hoá học.
Tên nguyên tố.
Khối lượng nguyên tử.
Trong đó, Số hiệu nguyên tử (Z) = số electron trong nguyên tử = số đơn vị điện tích hạt nhân = số thứ tự của nguyên tố trong bảng tuần hoàn.
- Chu kì
– Chu kỳ chình là các nguyên tố mà nguyên tử của chúng có cùng số lớp electron. Và chúng được sắp xếp thành hàng theo điện tích hạt nhân tăng dần xếp từ trái qua phải.
– Bảng tuần hoàn sẽ gồm có 7 chu kì, được đánh số từ 1 đến 7.
– Chu kì 1, 2, 3 được gọi là các chu kì nhỏ, chu kì 4, 5, 6, 7 là các chu kì lớn.
Ví dụ 2: Chu kì 1 bao gồm hai nguyên tố H và He, chu kì 2 sẽ bao gồm 8 nguyên tố từ Li đến Ne, chu kì 3 bao gồm 8 nguyên tố từ Na đến Ar.

Chu kỳ 2 gồm các nguyên tố sau
- Nhóm nguyên tố
– Bảng tuần hoàn gồm có 8 nhóm A, và được đánh số từ IA đến VIIIA cùng 8 nhóm B được đánh số từ IB cho đến VIIIB.
– Các nguyên tố trong cùng một nhóm A sẽ có số electron lớp ngoài cùng giống nhau. Cũng chính vì vậy mà chúng có tính chất hoá học tương tự nhau.
– Trong cùng một nhóm, khi đi từ trên xuống dưới thì điện tích hạt nhân tăng dần.
– Số thứ tự của nhóm A được tính bằng số electron lớp ngoài cùng trong nguyên tử của các nguyên tố thuộc nhóm đó.

Nhóm nguyên tố IA
Vị trí các nhóm nguyên tố kim loại, phi kim và khí hiếm
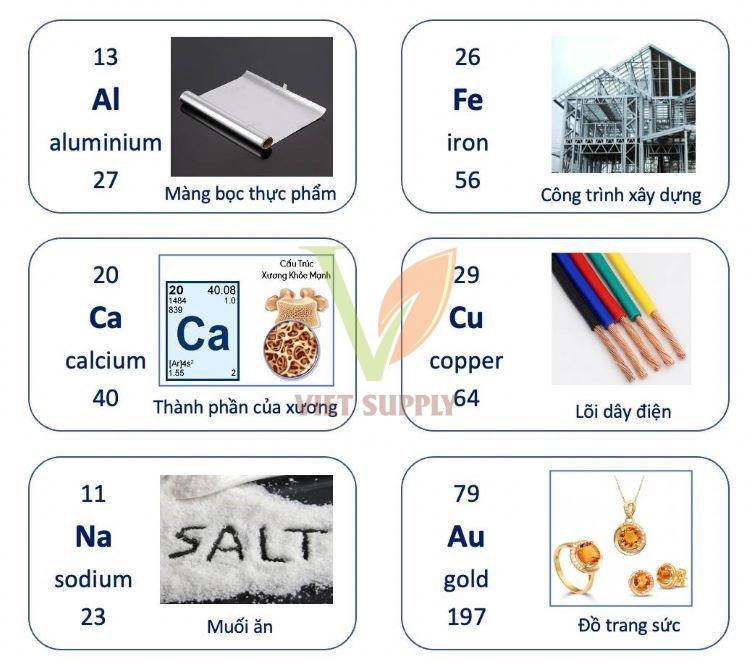
Các nguyên tố kim loại trong bảng tuần hoàn
– Trong số 118 nguyên tố hoá học đã biết thì có hơn 90 nguyên tố là kim loại.
– Vị trí nguyên tố kim loại trong bảng tuần hoàn như sau
Hầu hết là các nguyên tố thuộc nhóm IA, IIA, IIIA và một số nguyên tố ở các nhóm IVA, VA, VIA.
Các nguyên tố thuộc nhóm IB đến VIIIB, cùng các nguyên tố lanthanide và actinide đứng cuối bảng tuần hoàn.
Các nguyên tố kim loại trong bảng tuần hoàn
Các nguyên tố phi kim có trong bảng tuần hoàn
– Trong số 118 nguyên tố hoá học đã biết thì ít hơn 20 nguyên tố là phi kim.
– Ở điều kiện thường, chúng có thể ở thể rắn, thể lỏng hay thể khí.
– Vị trí nguyên tố phi kim trong bảng tuần hoàn hóa học lớp 7:
Hầu hết các nguyên tố phi kim thuộc nhóm VA, VIA, VIIA.
Một số nguyên tố thì thuộc nhóm IIIA, IVA.
Ví dụ: Nguyên tố H nằm ở nhóm IA.
Các nguyên tố khí hiếm
– Trong số 118 nguyên tố hoá học đã biết thì có 7 nguyên tố là nguyên tố khí hiếm.
– Nguyên tử của chúng đặc trưng là có lớp electron ngoài cùng bền vững nên khó bị biến đổi hoá học.
– Nguyên tố khí hiếm nằm ở nhóm VIIIA trong bảng tuần hoàn hóa học.




